技术支持Technical Support
联系我们CONTACT US
 400-999-210024小时服务热线
400-999-210024小时服务热线
细胞学堂 | 外泌体分离不再难!普诺赛®四大试剂盒全面解析
来源:Pricella 浏览量: 发布时间:2025-03-28 11:00:00
外泌体作为细胞间通讯的重要介质,其高纯度、高回收率的分离对下游功能分析、组学检测及疾病诊断至关重要。然而,传统外泌体提取方法往往面临设备要求高、操作流程复杂等挑战。为此,普诺赛®针对性开发了多种分离方案,以满足不同样品类型与研究需求。
在上期细胞学堂中,我们梳理了常用的外泌体分离方法,本期我们将进一步聚焦普诺赛®推出的四款外泌体分离试剂盒,详细解析其核心原理、操作流程、注意事项及优势,助力您挑选最适合的产品。
微量外泌体分离试剂盒(磁珠法)
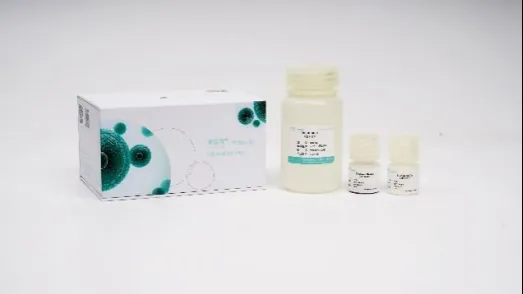
货号:
试剂盒组分:
Exosome Beads、
Solution A、
Elution Buffer
(点击产品图查看详情)
原理概述
利用自主研发的均相液体磁珠(Exosome Beads),通过磁珠特异性结合外泌体而不吸附杂质,以及磁性分离技术,达到高纯度和高回收率的分离效果。
操作流程
1
样品预处理:差速离心(300 g,5 min→2000 g,10 min→14000 g,30 min)逐步去除样品中细胞、细胞碎片及大体积颗粒;
2
富集外泌体:向去除了保护液的磁珠中加入预处理后的样品,置于摇床室温旋转孵育30 min;
3
洗涤:置于磁力架上,静置30s,弃上清,并用Solution A洗涤,重复2次,保留磁珠;
4
分离外泌体:加入Elution Buffer后置于摇床室温旋转孵育30 min;置于磁力架上,静置30s,转移上清到新的离心管中,该上清即为分离的外泌体。
注意事项
在某些样品中,磁珠结合外泌体时可能会结团,但不影响分离效果,无需处理;
完成分离后的外泌体不宜长时间在Elution Buffer中保存。若长时间保存,可使用超滤管将溶液置换为PBS。
优势
分离的外泌体纯度高且完整性好,适合分离微量或珍贵样品中外泌体;分离操作简便,仅需常规磁力架,无需特殊设备,高通量,能同时处理多个样本,兼容自动化操作。
通用外泌体分离试剂盒(SEC法)
货号:
试剂盒组分:
Exosome Purification Column、
Column Adapter
(点击产品图查看详情)
注:P-CA-502和P-CA-503仅产品规格和样品上样量有区别,其他操作是一致的。
原理概述
基于分子排阻色谱原理,利用外泌体纯化柱(Exosome Purification Column)中的多孔凝胶颗粒作为填料,这些填料颗粒根据颗粒大小形成不同的孔道,使得在PBS缓冲液流动的过程中,将样品中外泌体与其他不同尺寸的颗粒进行分离。
操作流程
1
样品预处理:差速离心(300 g,5 min→2000 g,10 min→14000 g,30 min)逐步去除样品中细胞、细胞碎片及大体积颗粒;
2
纯化柱预处理:将纯化柱在室温平衡30 min,检查并排除空气,PBS平衡纯化柱;
3
外泌体分离:待样品完全进入纯化柱,分批加入0.5 mL PBS,并收集流穿液,其中4-8号管(P-CA-502)或8-12号管(P-CA-503)中收集的流穿液即为分离的外泌体;
4
纯化柱维护:先后加入PBS和20%乙醇清洗纯化柱,再将纯化柱加满20%乙醇密封,于4℃保存。
注意事项
本操作中使用的PBS和20%乙醇建议现配现用,同时经0.2 μm滤膜过滤、超声或真空脱气,避免造成纯化柱出现大量气泡,影响分离效果;
纯化柱使用前需充分平衡至室温(18-25℃),温度过低或过高,都会影响外泌体分离效果;
纯化柱中间不能有气泡,使用前后需认真检查,避免影响外泌体分离效果;
纯化柱可以反复利用,但多次使用会影响纯化效果,建议重复使用不超过5次;
当分离的外泌体进行NGS或者其他组学分析时,为避免交叉污染,建议每个样品使用一支新的纯化柱。
优势
分离的外泌体纯度高、回收率高;操作简单,无需专业的纯化设备,可获得无蛋白污染、用于鉴定检测和功能研究的高质量外泌体。
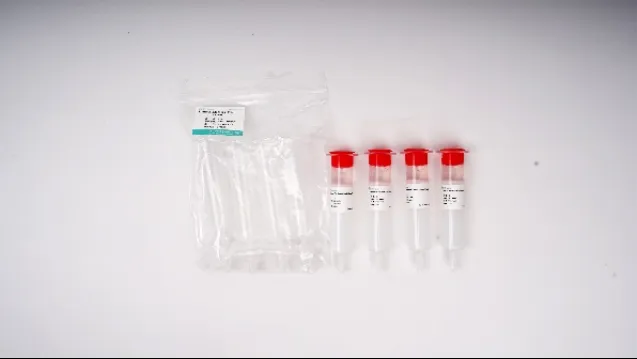
离心柱式外泌体分离试剂盒

货号:
试剂盒组分:
Spin Column 01、
Collection Tubes (2 mL)、
Solution A
(点击产品图查看详情)
原理概述
离心柱中装填的介质能无差别吸附杂质而不结合外泌体,利用离心力实现样品中外泌体与杂质的分离。此法不仅可快速分离外泌体,还可去除游离的外泌体标记染料。
操作流程
1
样品预处理:差速离心(300 g,5 min→2000 g,10 min→14000 g,30 min)逐步去除样品中细胞、细胞碎片及大体积颗粒;
2
离心柱预处理:弃去离心柱(Spin Column 01)上层的保护液体,加入Solution A离心洗涤;
3
外泌体分离:将预处理后的样品加入离心柱中,离心获得的洗脱液即为分离的外泌体。
注意事项
单个离心柱最大上样体积为500 μL,若样品体积超过500 μL,则建议试用50 kDa超滤管浓缩样品至0.5 mL,注意浓缩体积不超过20倍;
对高粘度样品,如血浆、血清、胸腹水等样本,可用等体积去离子水稀释再加入到离心柱中;
对杂质较多的样品,如血浆、血清、胸腹水、牛奶等样本,建议用PBS稀释10倍后,经过50 kDa超滤管浓缩10倍;然后加入剩余液体10倍体积的PBS,超滤浓缩10倍后,再用离心柱分离外泌体;
离心法分离时,控制离心力在300-500×g;若样品粘度大,可适当增加离心力,以确保分离效果。
优势
外泌体分离操作简便、高纯度和高富集量,无需磁力架、超速离心机等特殊设备;能去除游离的外泌体标记染料。
外泌体分离试剂盒(沉淀法)

货号:
试剂盒组分:
Exosome Precipitation Solution、
Solution A
(点击产品图查看详情)
原理概述
通过添加特定的试剂(如Exosome Precipitation Solution),使样品中的外泌体迅速聚集沉降,再通过离心收集沉淀中的外泌体。
操作流程
1
样品预处理:差速离心(300 g,5 min→2000 g,10 min→14000 g,30 min)逐步去除样品中细胞、细胞碎片及大体积颗粒;
2
沉淀外泌体:血清/血浆样品按照样品:Solution A:Exosome Precipitation Solution=2:2:1的体积比混匀;细胞培养上清/尿液样品按照样品:Exosome Precipitation Solution=4:1的体积比混匀;室温孵育30 min或4℃孵育过夜;
3
外泌体回收:高速离心,吸弃上清,向沉淀中加入Solution A重悬沉淀,再次离心收集上清,即为分离的外泌体。
注意事项
注意样品与各试剂的体积比,严格按照推荐比例操作;
细胞培养上清或尿液样品体积过大,可以先进行浓缩再进行沉淀;
操作要轻柔,吸弃上清时避免吸到沉淀影响外泌体得率;
实验时间允许情况下,为保证外泌体分离的高回收率,推荐4℃孵育过夜。
优势
适用样品广,外泌体回收率高、重复性好;无需特殊设备,操作简便快速,能同时处理多个样本。
希望这篇关于外泌体分离试剂盒的选用指南能帮助到您!更多细胞培养相关干货,请持续关注细胞学堂专栏~