技术支持Technical Support
联系我们CONTACT US
 400-999-210024小时服务热线
400-999-210024小时服务热线
细胞学堂 | 脂质体细胞转染干货分享
来源:Pricella 浏览量: 发布时间:2022-02-15 15:47:39
在我们的日常基础实验研究中后期,往往会进入到机制的研究,需要研究某个基因或者蛋白对细胞的表型或者功能的影响,大部分都会运用到转染技术。
细胞转染,是指将外源DNA或者RNA片段导入细胞中,从而使细胞获得新的表型的过程。常见的细胞转染的方法,主要有物理介导(电穿孔法、显微注射和基因枪法等)、化学介导(磷酸钙法、脂质体介导法等)、生物介导(各种病毒介导的转染等)三种方法。
评价转染效果的好坏,主要看两个方面:一是较高的转染效率,二是较低的细胞毒性。由于电击法和磷酸钙法的实验条件需要多次摸索优化、难度较大,病毒法的成本较高,前期准备时间较长,所以现在很多普通细胞系,多采用脂质体法。
脂质体转染是利用带正电的阳离子脂质体,与核酸通过静电作用,将DNA分子包裹入内,形成DNA脂复合物,同时也能被表面带负电的细胞膜吸附,再通过融合或细胞内吞进入细胞。
由于这种转染方法具有好的重现性和较高的转染效率,不仅适用于贴壁细胞,对悬浮细胞也适用,所以目前使用的较多。不过需要通过预实验来确定适当的细胞接种密度和转染时间,选择最佳的转染条件。
脂质体转染实验步骤(以lip2000为例)
1、 细胞准备
将处于对数生长期的细胞进行消化,接种到相应的培养皿或者孔板中, 根据细胞的生长快慢,来确定细胞的接种密度,使细胞转染前的密度达到50%~70%,密度不易过大。
2、细胞转染
吸去细胞培养皿/培养孔板中的旧培养基,用预温PBS或者无血清培养基清洗,去除残留血清。更换无血清和双抗的基础培养基(6孔板2毫升/孔),放37度培养箱培养。同时准备转染液,用灭菌后的EP管制备。以六孔板一个孔的量为例:
A液:用250μl Opti-MEM稀释4μg质粒;
B液:用250μl Opti-MEM稀释10μl lipo2000。
分别将A液、B液轻轻混匀,室温静置5min,将B液全部加入至A液中,轻轻混匀,室温静置20min。
将转染混合液均匀滴加到每个孔中轻轻混匀,放培养箱培养4 h-6 h后,去除质粒复合物,更换成完全培养基,继续培养到24-48小时(不同的质粒和脂质体最佳搭配比例不同,转染前,应该摸一个最佳配比。质粒:脂质体=1:1,1:1.5,1:2,1:2.5,1:3,1:3.5的梯度比例来检测最佳转染比例,一般质粒有带荧光,可以通过观察每组荧光强弱来判断转染效率)。以下为不同规格的培养板需要加DNA和lipo2000的量。
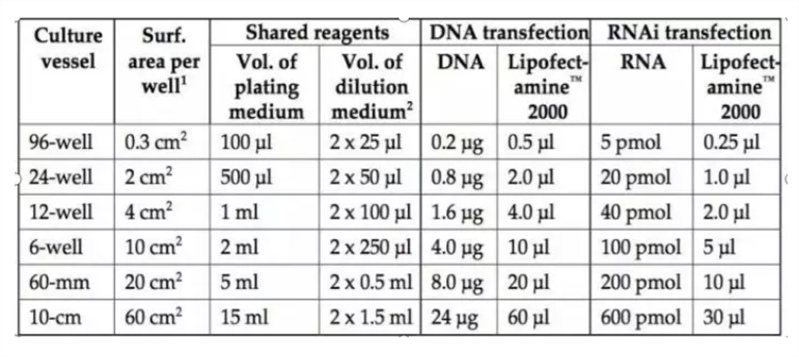
转染操作小贴士
1:应使用优质质粒。可以通过测量OD 值来确定DNA纯度和浓度,OD值应介于1.7-1.9之间。脂质体转染基于电荷吸引原理,如果DNA不纯,如带少量的盐离子、蛋白、代谢物污染,都会显著影响转染复合物的有效形成及转染的进行。
2:混合时需动作轻柔。转染时,小心轻柔地将lipo2000加到培养基中并轻轻混匀,避免粗暴用力吹打,会导致脂质体失效。
3:根据实验需求,提前计算好需用的总质粒量和lipo2000量,大体积地制备,可以减少误差。
4:细胞转染中,使用的是无血清和双抗的培养基。血清的存在会影响DNA-转染复合物的形成,而抗生素在转染试剂增加了细胞的通透性时,也会进入细胞从而间接导致细胞死亡,造成转染效率低。
5:转染后6h更换含血清的培养基,因为lipo2000具有一定毒性。
脂质体转染也存在一定的弊端,目前已有文献研究表明,脂质体可能会抑制ATP酶活性,从而影响细胞的生理活动。尽管如此,目前学界暂时没有其它更高效转染方法。
3、观察转染的效果
在转染后24 h,选择合适的荧光激发光,用荧光显微镜观察实验结果,并记录荧光蛋白表达情况,如下图所示,说明转染成功,且转染效率理想;如果不带荧光,可以用GFP来对照,放在一个单独的孔中,或是与目标质粒共转染,同时用Q-PCR、 WB、FCM来检测。
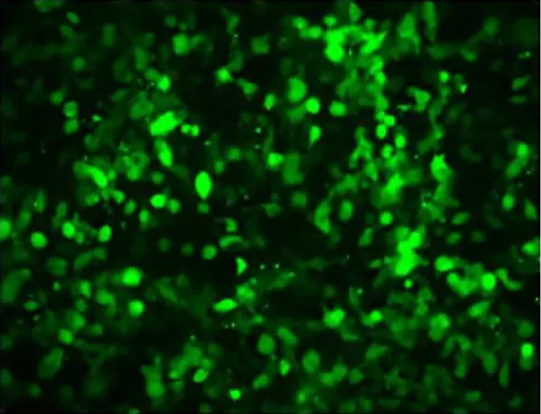
转染后,如果发现转染效率不高,可以参考以下几点:
1、复转染,即转染后12 h-24 h再次进行转染。前提是该细胞对脂质体的耐受性较好,转染后细胞死亡数较少。
2、通过药筛来杀死未转染成功的细胞。前提是该质粒带有抗生素抗性的基因。
3、一般的瞬时转染,随着传代的次数增多,转染效率会随着减低。
温馨提醒:
如果您想要了解或选购细胞系或者原代细胞,请点击我要选购,有任何疑问也可以点击右方的在线咨询,专业技术人员将为您提供解答。



































